Von Prof. Dr. med. Kurt Lippuner, Direktor und Chefarzt Universitätsklinik für Osteoporose, Inselspital, Universität Bern
Sclerosteose und die Entdeckung von Sclerostin: von einer seltenen Erbkrankeit zur Entdeckung eines wichtigen Regulators des Knochenumbaus und der Knochendichte.
Sclerosteose ist eine seltene Erbkrankheit, welche durch Mutation im SOST Gen zu einem verminderten Sclerostin Spiegel führt (Brunkow ME, Am J Hum Genet 2001). Etwa 1 von 140 Afrikaanders, einer südafrikanischen ethnischen Gruppe, die von niederländischen Siedlern abstammt, welche im 17./18. Jahrhundert zum ersten Mal am Kap der Guten Hoffnung ankamen, sind Träger des defekten Gens.
Insgesamt gibt es weniger als 100 Fälle mit Sclerosteose. Diese zeichnen sich aus durch:
-robustes Knochenwachstum, welches sich ab dem mittleren Kindesalter manifestiert
-normale aber dichte Knochenarchitektur (Abbildung 1).
-Fraktur-resistente Knochen
-lebenslängliches Überwachstum des Knochens mit gesundheitlichen Folgen, wie z.B. Hirnnervenschädigungen an deren Austrittsstellen des Schädels, welche zu eng werden
-heterozygote Genträger, d.h. solche, welche ein defektes SOST Gen (Allel) von einem Elternteil, vom anderen jedoch gleichzeitig ein normales SOST Gen geerbt haben, zeigen weniger gesundheitliche Komplikationen aufgrund überschiessenden Knochenwachstums, haben aber trotzdem überdurchschnittlich feste Knochen. Daraus lässt sich schliessen, dass der Effekt von Sclerostin «titrierbar» ist.
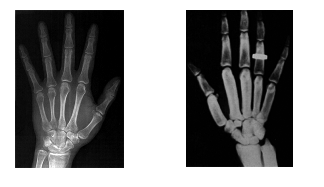
Abbildung 1. Röntgenbild eines Handskeletts eines Menschen mit Sclerosteose im Vergleich zu einem normalen Handskelett.
Am Modell der Ratte mit deaktiviertem SOST Gen lässt sich der Effekt des Sclerostin Mangels auf den Knochen reproduzieren (Abbildung 2).
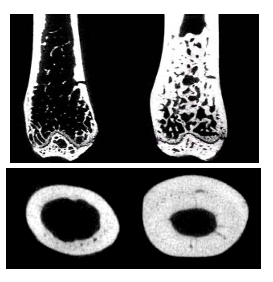
Abbildung 2. µCT Analyse des Oberschenkelknochens (oben Längsschnitt, unten Querschnitt) einer normalen Ratte (links) bzw. einer Ratte mit inaktiviertem SOST Gen (rechts). Letztere weist also einen Sclerostin Mangel auf. Dieser führt -wie die Bilder zeigen- zu einem erhöhten Knochenvolumen, sowohl des Bälkchenknochens (innen) als auch der corticalen Hülle des Knochens. Die mechanische Testung zeigt zudem eine deutlich erhöhte Festigkeit der Knochen der Ratte mit inaktiviertem SOST Gen (Li X et al, J. Bone Miner. Res. 2008).
Die Rolle von Sclerostin im Knochenstoffwechsel (Abb. 3)
Osteocyten sind Knochenzellen, welche mit ihren Ausläufern ein Netzwerk innerhalb der Knochenmatrix bilden. Sie reagieren auf biochemische und biomechanische Signale mit der Ausschüttung (Sekretion) verschiedener Faktoren, darunter Sclerostin, welche die Osteoblasten und Osteoklasten regulieren. Sie sind gewissermassen die «Key player» in der Regulation von Knochenabbau und -Anbau.
Sclerostin ist ein Glycoprotein, welches als Antwort auf mechanische Belastung oder Hormone (z.B. Nebenschilddrüsenhormon) gebildet und ausgeschüttet wird.
Sclerostin hat eine zweifache Funktion:
- a) es verhindert die Osteoblasten-Entwicklung (Differenzierung) und -Vermehrung (Proliferation) und limitiert so die Knochenbildung
- b) es enthemmt die Osteoklasten-Entwicklung (über Aktivierung von RANK-Ligand) und fördert dadurch den Knochenabbau (Resorption).
Dies wird erreicht, indem Sclerostin die Andockstelle für «Wnt» an der Zelloberfläche der Osteoblasten blockiert und damit den wichtigen «Wnt Signalpfad» behindert, welcher zur Knochenbildung führt und den Knochenabbau hemmt.
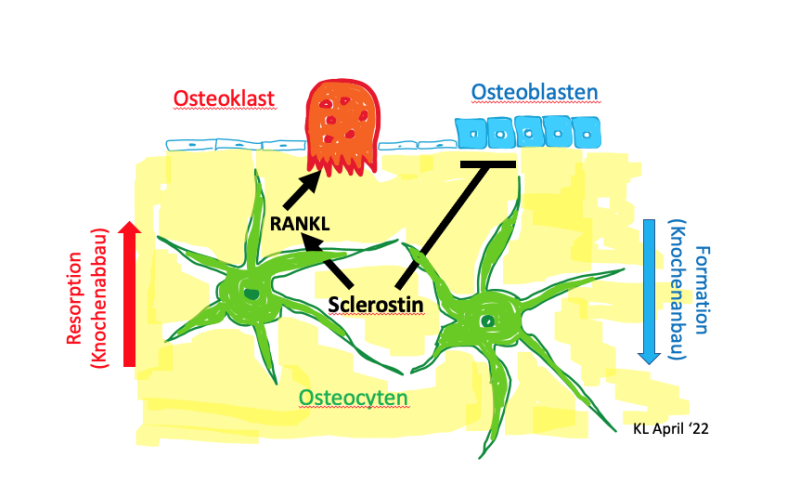
Abbildung 3. Regulation von Knochenan- und -abbau durch Sclerostin
Hemmung von Sclerostin durch Romosozumab – ein bahnbrechender therapeutischer Ansatz bei Osteoporose-Patientinnen mit sehr hohem Frakturrisiko
Aus dem bisher Gesagten lässt sich ableiten, dass die Hemmung von Sclerostin am Knochen ein idealer Ansatz zur Osteoporose-Behandlung ist.
In einer langjährigen Zusammenarbeit der beiden Pharma- und Biotechnologieunternehmen Amgen und UCB ist es gelungen, einen humanisierten monoklonalen Antikörper zu entwickeln, welcher Sclerostin bindet, dieser Antikörper erhielt den Namen Romosozumab.
Romosozumab steigert einerseits die Knochenneubildung, indem es die Osteoblasten-entwicklung und -Aktivität fördert, andererseits hemmt es den osteoklastären Knochenabbau, was synergistisch zu einer Zunahme der Knochenmasse und Erhöhung der Knochenfestigkeit führt.
Romosozumab (Handelsnahme: Evenity®) hat in den letzten 10 Jahren erfolgreich alle klinischen Prüfungen absolviert, wurde im Juli 2020 von der Schweizer Arzneimittelbehörde Swissmedic zugelassen und hat im Februar 2022, die Limitatio des BAG erhalten, d.h. es wurden die Bedingungen festgelegt, unter welchen Romosozumab von den Kassen aufgrund einer Anfrage für Kostengutsprache vergütet wird. Wir kommen darauf zurück. Zuerst aber zu den wichtigsten Fakten betreffend Wirksamkeit und Sicherheit von Romosozumab (Evenity®):
Wirkung von Romosozumab auf die Knochendichte (Abb.4)
In der klinischen Phase 2 Studie wurde die effektivste Dosis von Romosozumab eruiert. Hierzu wurde über ein Jahr der Effekt von Romosozumab (subcutan in verschiedenen Dosierungen injiziert: 70mg, 140mg oder 210mg 1-monatlich bzw. 140mg oder 210mg 3-monatlich) auf die Knochendichte im Vergleich zu Plazebo (subcutan), Alendronat (70mg Wochentablette) und Teriparatid (20 μg subcutan 1x täglich) bei 419 postmenopausalen Frauen untersucht. Die Patientinnen waren zwischen 55- und 85- jährig und hatten einen T-score von zwischen -2.0 und -3.5 an LWS, Gesamthüfte oder Schenkelhals (Mc Clung M et al; N Engl J Med 2014). Zudem wurden auch die biochemischen Marker des Knochenumbaus untersucht.
Abbildung 4 zeigt die prozentuale Zunahme der Knochendichte an der Lendenwirbelsäule, welche mit den jeweiligen Therapien erreicht wurde. Unter den Dosierungen von Romosozumab erwies sich die 210mg Dosis 1x monatlich als am wirkungsvollsten. Die Knochendichtezunahme unter Romosozumab innert 12 Monaten war mit 11.3% (!) deutlich grösser als unter den Vergleichstherapien. Diese enorm hohe Wirksamkeit von Romosozumab beschränkt sich auf ein Jahr, danach flacht der Effekt ab. Es würde also keinen Sinn machen, länger als ein Jahr zu behandeln.
Die Analyse der biochemischen Marker des Knochenstoffwechsels zeigte unter Romosozumab eine Zunahme des Knochenanbaus sowie gleichzeitig eine Abnahme des Knochenabbaus, so wie man es aufgrund der Hemmung von Skerostin durch Romosozumab anhand der Mechanismen in Abbildung 1 erwartet.
Die in der Studie beobachteten Nebenwirkungen waren bis auf milde (meist einmalige) Reaktionen an der Einstichstelle von Romosozumab nicht unterschiedlich in den verschiedenen Behandlungsgruppen.
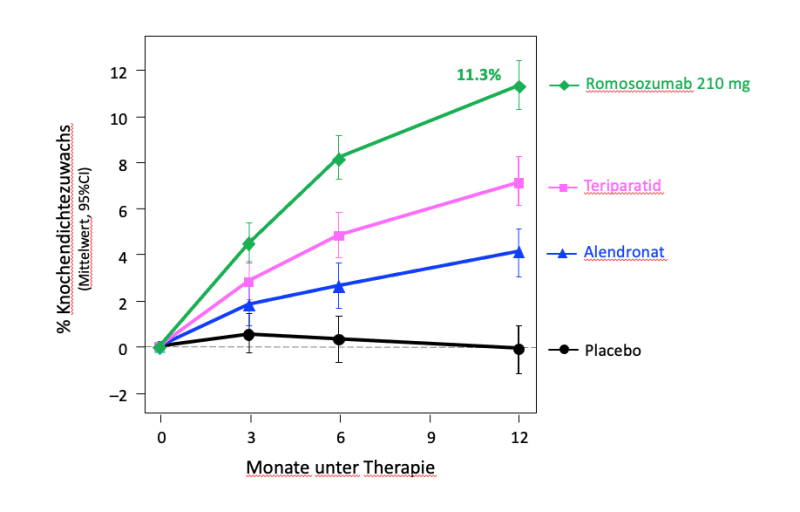
Abbildung 4. Klinische Phase 2-Studie zur Dosisfindung von Romosozumab. Wirkung auf die Knochendichte der Lendenwirbelsäule im Vergleich zu bereits etablierten Substanzen in der Therapie der Osteoporose anhand eines Kollektivs postmenopausaler Frauen mit Osteopenie bzw. Osteoporose.
Wirkung von Romosozumab auf die Frakturhäufigkeit (Abb.5)
Nachdem die optimale Dosis von Romosozumab zur Osteoporosetherapie gefunden war, wurde in der nachfolgenden klinischen Phase 3 Studie die Wirksamkeit von Romosozumab 210mg 1x monatlich auf das Knochenbruchrisiko bei postmenopausalen Frauen mit Osteoporose untersucht: FRAME Studie (für «FRActure study in postmenopausal woMen with ostEoporosis», Cosman F et al, New Engl J Med 2016).
In diese Studie wurden 7180 Frauen (55-90-jährig) mit einem T-score von -2.5 bis -3.5 an der Hüfte bzw. am Schenkelhals eingeschlossen. Rund 18% der Frauen hatten bereits eine (14%) oder 2 (4%) Wirbelfrakturen und 22% eine andere Fraktur erlitten. Die Patientinnen wurden «doppelblind» einer von zwei Behandlungsgruppen, Romosozumab 210mg 1x monatlich subcutan bzw. Plazebo 1x monatlich subcutan, zugeordnet. Neben der monatlichen Studienmedikation (Romosozumab oder Placebo) erhielten alle Patientinnen Kalzium (500-1000mg/d) und Vitamin D (600-800 IE/d).
Im 2. Studienjahr erhielten alle Patientinnen Denosumab 60mg 6-monatlich subcutan gespritzt. Der primäre Endpunkt der Studie war das Auftreten neuer Wirbelbrüche nach 12 und 24 Monaten, sekundäre Endpunkte waren das Auftreten klinischer Frakturen (symptomatische Wirbelfrakturen plus nicht-Wirbelbrüche) und nonvertebraler Frakturen.
Abbildung 5 zeigt die Resultate nach 12 bzw. 24 Monaten der Studie in den beiden Behandlungsgruppen in Bezug auf Patientinnen mit neuen Wirbelfrakturen. Unter Romosozumab erlitten lediglich 0,5% (16 von 3'321) der Patientinnen eine neue Wirbelfraktur, währenddem unter Placebo 1,8% (53/3'322) der Patientinnen einen solchen Bruch erlitten. Dies entspricht einer relativen Risikoreduktion um 73% durch Romosozumab.
Auch klinische Frakturen waren nach 1 Jahr signifikant weniger häufig unter Romosozumab 1.6%) als unter Placebo (2.5%) entsprechend einer 36% Risikoreduktion durch Romsosozumab (Resultate nicht abgebildet).
Die Häufigkeit von unerwünschten Nebenwirkungen war ausgeglichen zwischen den Behandlungsgruppen (speziell bezüglich der Kategorien: Arthrose, Hyperostose, Tumore, Überempfindlichkeitsreaktionen und kardiovaskuläre Ereignisse). Reaktionen an der Einstichstelle, die in der Regel mild waren, wurden häufiger in der Romosozumabgruppe (5,2% in den ersten 12 Monaten) als in der Plazebogruppe (2,9%) beobachtet.
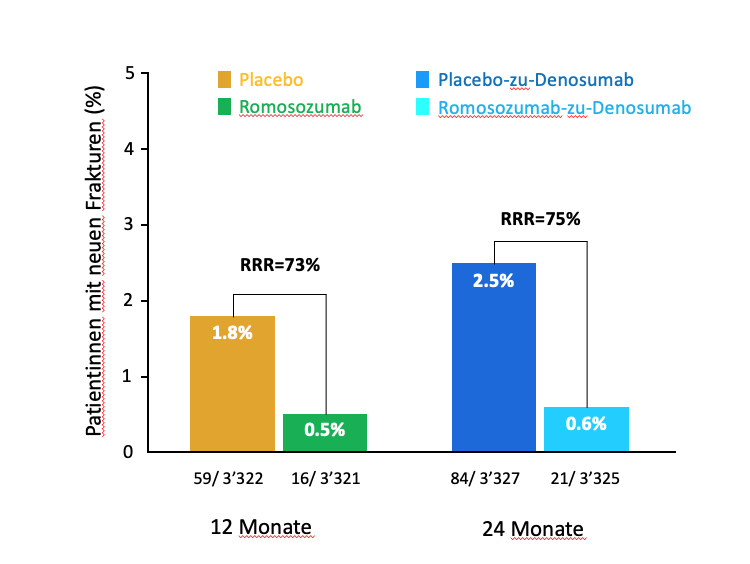
Abbildung 5. Klinische Phase 3 Studie mit Romosozumab versus Placebo an 7180 postmenopausalen Frauen. (FRAME Studie, Cosman F et al, N Engl J Med 2016). Primärer Endpunkt: Patientinnen mit neuen Wirbelfrakturen nach 12 und 24 Monaten. Studiendesign siehe Text. RRR: Relative Risikoreduktion.
Überlegenheit von Romosozumab gegenüber Alendronat in Bezug auf die Senkung des Frakturrisikos bei Osteoporose-Patientinnen mit sehr hohem Frakturrisiko (Abb. 6)
Aufgrund der überragenden Wirksamkeit von Romosozumab auf die Knochendichte und das Frakturrisiko, wurde in einem weiteren Schritt eine «head-to-head» Fraktur-Studie gegen Alendronat durchgeführt, dessen Antifraktur-Effekt seit Jahren belegt ist.
In diese «Active-Controlled Fracture Study in Postmenopausal Women with Osteoporosis at High Risk» (ARCH, Saag K, et al, New Engl J Med 2017) wurden 4'093 postmenopausale Frauen (55-90-jährig) eingeschlossen die einen T-score von kleiner oder gleich -2,5 (an Hüfte/ Schenkelhals) plus mindestens 1 moderate oder schwere Wirbelfraktur oder mindestens zwei milde Wirbelfrakturen aufwiesen. Auch Frauen mit T-score kleiner oder gleich -2 konnten eingeschlossen werden, sofern sie gleichzeitig mindestens 2 moderate oder schwere Wirbelfrakturen oder eine Hüftfraktur innerhalb der vorangehenden 3 bis 24 Monate vor Einschluss in die Studie erlitten hatten. Es handelte sich also um Patienten mit sehr hohem, teils imminentem Frakturrisiko. Die Patientinnen erhielten als Wirkstoff entweder monatlich subcutan romosozumab (210 mg) oder 1x wöchentlich eine Tablette mit 70mg Alendronat über 12 Monate. Die Studie war ebenfalls auf 2 Jahre ausgelegt und ein primärer Endpunkt waren radiologisch feststellbare neue Wirbelfrakturen nach 24 Monaten Behandlung. Im zweiten Jahr der Studie erhielten alle Patienten die Alendronat Wochentablette.
Bereits im ersten Jahr der Behandlung wurde das Risiko neuer Wirbelfrakturen durch das knochenanabole Romosozumab (1x pro Monat, subkutan) im Vergleich zum peroralen Bisphosphonat Alendronat (1x pro Woche) stärker gesenkt (Abb.6). Die relative Risikosenkung (RRR) im Vergleich zu Alendronat nach einem Jahr betrug unter Romosozumab 37%, (95% CI 0.47-0.85, p=0.003). Im 2. Jahr nahm die relative Risikoreduktion in der initial mit Romosozumab behandelten Gruppe weiter zu (auf 48%). Die Zahlen in den Balken zeigen die Anzahl von Patienten mit radiologisch festgestellten Wirbelbrüchen pro Gesamtzahl Patienten in der jeweiligen Behandlungsgruppe.
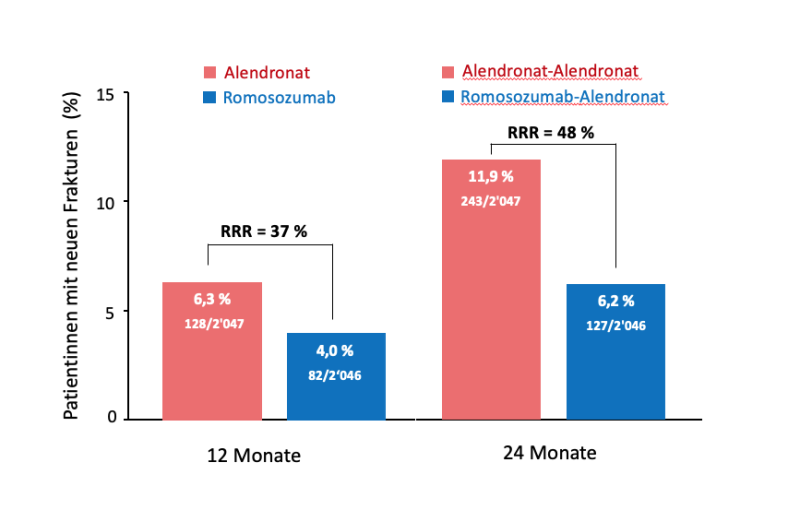
Abbildung 6. Klinische Phase 3 Studie (Head-to-Head Trial) mit Romosozumab versus Alendronat an 4’093 postmenopausalen Frauen (ARCH Studie, Saag K, et al, New Engl J Med 2017). Primärer Endpunkt: Patientinnen mit neuen Wirbelfrakturen nach 12 und 24 Monaten. Studiendesign siehe Text. RRR: Relative Risikoreduktion.
Insgesamt war die Häufigkeit von Nebenwirkungen ausgeglichen zwischen den beiden Behandlungsgruppen. Im ersten Studienjahr wurden jedoch mehr kardiovaskuläre Ereignisse in der Romosozumab- als in der Alendronat-Gruppe beobachtet (50 von 2040 Patienten [2.5%] vs. 38 von 2014 Patienten [1.9%]). Diese Beobachtung führte bei der Zulassung zur Anwendungseinschränkung von Romosozumab bei Patienten mit einer Vorgeschichte eines Myokardinfarkts oder eines Schlaganfalls.
Einsatzbereich von Romosozumab (Evenity®): ausschliesslich bei Patientinnen mit sehr hohem Frakturrisiko*
(*hier evtl Querverweis zum Artikel «Hohes und sehr hohes Knochenbruchrisiko – Konsequenzen in Bezug auf die Medikamenten Wahl bei der Osteoporose-Therapie. Neue Empfehlungen der Schweizerischen Vereinigung gegen die Osteoporose (SVGO»)
Aufgrund seiner Überlegenheit gegenüber dem peroralen Bisphosphonat Alendronat hinsichtlich der Frakturrisiko-Senkung bei Patientinnen mit sehr hohem Frakturrisiko (entsprechend den Einschlusskriterien der ARCH Studie) hat das BAG die Voraussetzung zur Kostenübernahme von Romosozumab wiefolgt festgelegt:
- EVENITY wird vergütet zur Behandlung einer schweren Osteoporose bei postmenopausalen Frauen mit:
- einem unmittelbaren/imminenten Frakturrisiko gemäss den SVGO-Empfehlungen 2020, d.h. eine Vorgeschichte einer typischen osteoporotischen Fraktur (Major Osteoporotic Fracture; MOF - Wirbel, Hüfte, Becken oder Humerus), innerhalb der letzten 24 Monate, in Verbindung mit einem T-Score ≤ -3.5 (gemessen an der Wirbelsäule oder Hüfte)
oder - einem sehr hohen Frakturrisiko gemäss den SVGO-Empfehlungen 2020, d.h. die 10-Jahres Wahrscheinlichkeit einer MOF, bewertet mittels FRAX-Tools muss altersunabhängig mindestens 20% über der Behandlungsschwelle liegen
oder - einer Vorgeschichte von mindestens zwei typischen osteoporotischen Frakturen.
- einem unmittelbaren/imminenten Frakturrisiko gemäss den SVGO-Empfehlungen 2020, d.h. eine Vorgeschichte einer typischen osteoporotischen Fraktur (Major Osteoporotic Fracture; MOF - Wirbel, Hüfte, Becken oder Humerus), innerhalb der letzten 24 Monate, in Verbindung mit einem T-Score ≤ -3.5 (gemessen an der Wirbelsäule oder Hüfte)
- Die Therapie bedarf der Kostengutsprache durch den Krankenversicherer nach vorgängiger Konsultation des Vertrauensarztes.
- Die Verschreibung von EVENITY darf nur von einem Facharzt FMH (Endokrinologen oder Rheumatologen) oder einem Spezialisten für Knochenerkrankungen vorgenommen werden, der in den für diesen Bereich anerkannten Spitalzentren tätig ist (Spitäler/Institute der Kategorie A, B und C gemäss der Liste der Weiterbildungsstätten der FMH (http://www.siwf-register.ch)) und/oder über ein FLS (Fracture Liaison Services) verfügt.
- Nach Abschluss der 12-monatigen Behandlung muss auf eine antiresorptive Therapie umgestellt werden, um den mit Romosozumab erzielten therapeutischen Nutzen zu verlängern.
Damit wird den neuen Guidelines der Schweizerischen Vereinigung gegen die Osteoporose (SVGO) Rechnung getragen und zum ersten Mal ein osteoanaboles Medikament als Erstlinienmedikation bei Osteoporosepatientinnen mit sehr hohem Frakturrisiko zugelassen.
Die SVGO-Guidelines finden Sie auf www.svgo.ch




